Introdução
A glândula tireoide pode ser a origem de diversos tipos histológicos de neoplasias malignas, sendo os mais comuns os originados de suas células foliculares, seguidos em uma quantidade muito menor pelos tumores das células parafoliculares, secretoras de calcitonina. Mais raramente a tireoide também pode ser a origem primária de tumores com histologia de origem tímica, de glândulas salivares e de células germinativas [1].
Nas últimas décadas houve aumento considerável da incidência de tumores malignos de tireoide, consequência da melhoria das condições de diagnóstico, e detecção precoce de tumores pequenos, assintomáticos e indolentes [2]. A maioria dos dados disponíveis apontam prognóstico excelente nas lesões diagnosticadas incidentalmente, com manutenção da taxa de mortalidade apesar do número crescente de casos novos [3]. Dados estatísticos do Instituto Nacional de Câncer dos Estados Unidos (SEER) publicados em 2017 demonstraram que o aumento da incidência dos carcinomas papilares de tireoide vem aumentando em média 4,6% ao ano, incluindo a detecção de tumores em estágios mais avançados. Além da constatação do aumento da taxa de mortalidade de 1,1% ao ano, entre 1994 a 2013 [4]. Estes números denotam o aumento real da incidência dos casos de câncer da tireoide.
Os carcinomas de tireoide oriundos das células foliculares podem ser do tipo papilar (85%), folicular (10%), oncocítico (3 a 4%) e anaplásicos (1 a 2%). O carcinoma papilar de tireoide (CPT) possui muitas variantes histológicas; as de melhor prognóstico são as clássicas e as foliculares; e as mais agressivas são a colunar de células altas, esclerosante difusa, hobnail e insular. O carcinoma folicular da tireoide (CFT) se caracteriza por sinais de invasão capsular e/ou vascular e ausência de sinais nucleares típicos do CPT, sendo classificado em minimamente ou amplamente invasivos. O carcinoma oncocítico é formado por células foliculares oxifílicas, marcadas por uma quantidade acentuada de mitocôndrias e com uma maior taxa de metástases hematogênicas, recorrência e mortalidade relacionadas ao tumor [5,6]. O carcinoma anaplásico é a neoplasia maligna mais rara entre os tumores com origem nas células foliculares da tireoide, apresenta altíssimo índice de mortalidade com sobrevida média de 6 meses e sobrevida global de 20% em 1 ano [7]. O carcinoma medular é proveniente das células C ou parafoliculares, são responsáveis por 1 a 2% dos carcinomas da glândula tireoide, pode se apresentar de forma hereditária entre 20 a 25% dos casos, podendo ser parte das síndromes de Neoplasias Endócrinas Múltiplas (NEM 2A e NEM 2B), e da síndrome de Carcinoma Medular Familiar [8].
Epidemiologia no Brasil
O carcinoma de tireoide pode ser considerado o câncer mais comum da região da cabeça e pescoço e o 7° tipo de câncer mais frequente, quando não consideramos o carcinoma de pele não melanoma. O Instituto Nacional de Câncer (INCa-MS Brasil) estima uma incidência de mais de 16.600 novos casos de câncer de tireoide ocorram por ano durante o triênio de 2023 a 2025 no Brasil. As mulheres são as mais afetadas, com incidência cinco vezes maior. A doença é o terceiro tipo de câncer mais frequente nas mulheres brasileiras da região Sudeste. Em 2020 foram registrados 837 óbitos no Brasil [9].
Fatores de risco
A exposição à radiação ionizante é um fator de risco conhecido para desenvolvimento do câncer de tireoide. O risco não está associado a realização de exames radiológicos, já que as doses de radiação são muito baixas e ocasionais. A preocupação decorre de tratamentos prévios com radioterapia na região de cabeça e pescoço, principalmente em pacientes jovens, em pacientes expostos a acidentes com vazamento de radioisótopos, e em profissionais com exposição inapropriada e/ou prolongada a radiação.
Algumas condições hereditárias também podem ser referidas como fator de risco, como na Síndrome de Gardner que é associada com aumento de risco para câncer de tireoide de 25 a 160 vezes [10, 11], e na Síndrome de Cowden que o paciente pode apresentar uma chance de desenvolver câncer de tireoide entre 3 a 10% (geralmente do tipo folicular) [12]. Estima-se que em média 4.2% dos carcinomas de tireoide papilares, foliculares e oncocíticos tem origem familiar, fazendo parte de uma entidade clínica descrita como Carcinoma Não Medular Familiar de Tireoide, quando o risco para apresentar estas neoplasias podem se elevar de 3.2 a 11.1% nos familiares [13].
Estadiamento
O estadiamento correto é importante para determinar a melhor terapêutica e o risco de mortalidade. É recomendado em todo o mundo o estadiamento da American Joint Committee on Cancer (AJCC 8° edição). Este é baseado no conjunto de fatores prognósticos da classificação TNM (T; tamanho do tumor primário, N; linfonodos loco-regionais e M; metástases a distância), e no caso de neoplasias papilares, foliculares e oncocíticas de tireoide, somados a idade do paciente ao diagnóstico. Estes tumores de tireoide são as únicas neoplasias malignas na qual a idade é fator prognóstico pela AJCC, sendo os pacientes com 55 anos ou mais referidos com fator de risco mais elevado. O TNM pode ser definido clinicamente, com auxílio de exames de imagem e por anatomopatológico [14,15,16,17].
Os guidelines da American Thyroid Association (ATA) auxiliam na estratificação de risco de recorrência da doença. Essa estratificação classifica os pacientes em baixo, intermediário ou alto risco. Nos casos de tumores papilares, foliculares e oncocíticos são considerados Risco baixo; os carcinomas sem invasão extra tireoidiana, com até 5 linfonodos acometidos por micrometastases (< 2 mm); risco intermediário aqueles com subtipo histológico desfavoráveis, invasão extra tireoidiana mínima, invasão vascular ou mais de cinco linfonodos acometidos por micrometastases ou menores que 3 cm, risco alto quando observado invasão extra tireoidiana evidente, ressecção incompleta do tumor, metástases a distância ou linfonodos maiores que 3 cm [18,19]. Para o carcinoma anaplásico todos os casos são classificados como Estagio IV (A, B e C) devido ao pobre prognóstico já referido. Estágio IV A todos os pacientes entre T1 a T3a, N0, M0, com doença sem extravasamento tireoidiano. Estágio IV B pacientes classificados entre T3b a T4, com linfonodos loco-regionais positivos. Estágio IV C para qualquer T ou N em pacientes com metástase a distância [7,20].
T – tumor primário
T0 sem evidência de tumor primário
T1 tumor com 2cm ou menos de dimensão, limitado a tireoide
T1a tumor com 1 cm ou menos de dimensão, limitado a tireoide
T1b tumor com mais de 1cm e menor que 2cm de dimensão, limitado a tireoide
T2 tumor maior que 2cm e menor que 4 cm na maior dimensão, limitado a tireoide
T3 tumor com 4 cm ou maior, limitado a tireoide ou com extravasamento grosseiro da tireoide invadindo musculatura pré-tireoidiana
T3a tumor maior que 4cm na maior dimensão, limitado a tireoide
T3b tumor de qualquer tamanho com extravasamento grosseiro da tireoide invadindo musculatura pré-tireoidiana
T4a tumor com extravasamento tireoidiano invadindo: tecido subcutâneo, laringe, traquéia, esôfago, nervo laríngeo recorrente
T4b tumor invade fáscia pré-vertebral, veias mediastinais, ou envolve artéria carótida
N – Linfonodos regionais
N0 sem linfonodos regionais metastáticos
N1 metástase em linfonodo regional
N1a metástase em nível VI (pré-traqueal, paratraqueal e pré-laríngeo/linfonodos de Delfos) ou mediastino superior
N1b metástases unilaterais, bilaterais ou contralaterais cervicais (níveis I, II III, IV ou V) ou retro faríngeos
M – Metástases a distância
M0 – sem metástases a distância
M1 metástases a distância
Papilar, Folicular e Oncocítico abaixo de 55 anos
Estágio I qualquer T qualquer N M0
Estágio II qualquer T qualquer N M1
Papilar, Folicular e Oncocítico com 55 anos ou mais
Estágio I – T1a,T1b,T2 N0 M0
Estágio II – T3 N0 M0 T1,T2,T3 N1 M0
Estágio III – T4a qualquer N M0
Estágio IVA – T4b qualquer N M0
Estágio IVB – qualquer T, qualquer N M1
Medular
Estágio I – T1a, T1b N0 M0
Estágio II – T2, T3 N0 M0
Estágio III – T1, T2, T3 N1a M0
Estágio IVA – T1, T2, T3 N1b M0, T4a qualquer N M0
Estágio IVB – T4b qualquer N M0
Estágio IVC – qualquer T, qualquer N M1
Anaplásico
Estágio IVA – T1,T2,T3a N0 M0
Estágio IVB – T1,T2,T3a N1 M0
Estágio IVB – T3b,T4a,T4b N0,N1 M0
Estágio IVC – qualquer T, qualquer N, M1
Tratamento
A ressecção cirúrgica é o tratamento de escolha para as neoplasias malignas da tireoide, com a extensão do procedimento cirúrgico individualizada e indicada de acordo com estratificação de risco, o que leva em conta desde características do paciente, ao tipo da neoplasia e o estadiamento da doença. O intuito é evitar tratamentos desnecessários que possam acarretar morbidade e prejuízo na qualidade de vida. A radioiodoterapia é um importante tratamento adjuvante com indicações bem definidas e aplicada sobretudo nos carcinomas do tipo papilar, folicular e oncocítico. A radioterapia externa pode ser indicada em algumas situações para tratamento de tumores mais agressivos como o medular e o anaplásico, ou em casos selecionados e mais avançados de tumores da tireoide.
Tratamento cirúrgico, Extensão da tireoidectomia
Para os carcinomas de tireoide dos tipos papilar e folicular menores que 4cm, sem extravasamento capsular e sem evidências de metástases loco-regionais ou à distância, a lobectomia tem sido considerada a opção de escolha, já que nestes casos a maioria dos trabalhos não demonstra aumento da sobrevida global quando comparados a pacientes submetidos a retirada total da glândula [19,21,22,23,24]. Porém, a tireoidectomia total pode ser indicada de maneira individualizada, de acordo com necessidades específicas de cada caso clínico. A variante folicular encapsulada do carcinoma papilar apresenta característica de tumor indolente e de baixa agressividade e pode ser tratada apenas com lobectomia. Para os tumores com 4cm ou maiores, com extravasamento capsular grosseiro, com metástases, de variantes histológicas agressivas, histórico familiar de câncer de tireoide ou de tratamento radioterápico na infância, a indicação é para tireoidectomia total [19,21,25, 26]. A Sociedade Japonesa de Cirurgiões de Tireoide considera aceitável a conduta não cirúrgica e apenas de vigilância ativa para os microcarcinomas papilíferos (≤ 1cm) em pacientes idosos, sem metástases linfáticas e/ou extravasamento capsular [26]. A conduta de vigilância ativa para microcarcinomas papilíferos, únicos, sem metástases e sem extravasamento capsular tem ganhado opiniões favoráveis [27]. De fato, a vigilância ativa poderia ser considerada a regra se os nódulos tireoidianos sem características de agressividade não fossem puncionados quando menores que 1cm.
Os carcinomas de células oncocíticas tem indicação para tireoidectomia total, pois apresentam-se de forma mais agressiva e com maior tendencia de metástases à distância [21].
A tireoidectomia total é indicada para todos os casos de carcinoma medular [8,21,25].
Em relação ao carcinoma anaplásico, mesmo em fases precoces, o tratamento cirúrgico inicial pode ser bem desafiador, já que menos de 10% destes tumores apresentam-se intra-tireoidianos ao diagnóstico. Não há consenso definido sobre a extensão da tireoidectomia, mas quando possível considera-se como a melhor opção cirúrgica a ressecção completa da tireoide e do tumor (R0, R1), sendo evitado ressecções radicais que envolvam a laringe, faringe, esôfago e grandes vasos mediastinais, devido ao pobre prognóstico [20]. Nos últimos 5 anos houve progresso considerável na indicação de tratamento neoadjuvante com terapia alvo, principalmente com inibidores BRAF e imunoterapia, com redução do tamanho da cirurgia e morbidade [28]. Estas novas possibilidades terapêuticas denotam a exigência de testes moleculares e de mutações genéticas o mais breve possível ante ao diagnóstico de carcinoma anaplásico. Entre os mais importantes o BRAFv600E, BRAFWILD, NTRK. Até 50% dos pacientes podem apresentar mutação no BRAF, e esta característica tem demonstrado importância terapêutica promissora.
Tratamento cirúrgico, Linfadenectomia
A alta incidência de metástases linfáticas no câncer de tireoide sempre coloca a indicação do esvaziamento cervical como um tema muito importante. No carcinoma papilar as metástases para linfonodos cervicais do compartimento central podem ocorrer entre 14 a 64%, e até a números mais elevados se somada a presença de micrometastases (≤ 2mm). Porém a identificação destas micrometastases não denota um fator associado ao risco para recorrência. No carcinoma folicular as metástases linfáticas ocorrem em bem menor quantidade, entre 2.1 a 3.3%, e no carcinoma medular entre 44 a 81% [29]. A situação é muito mais grave nos carcinomas anaplásicos, onde as metástases podem ocorrer em órgãos distantes em mais de 40%, já na apresentação da doença [20].
Esta alta incidência de metástases demonstra a grande importância do correto estadiamento pré-operatório para definição da abordagem das cadeias linfáticas cervicais. O ultrassom realizado por profissional experiente mostra-se o exame mais sensível para detecção das metástases cervicais, podendo obter melhora nos resultados se somado a tomografia computadorizada. Para os carcinomas medulares e anaplásicos os exames de imagem dever ser mais abrangentes, incluindo tomografia computadorizada ou ressonância nuclear magnética do pescoço, tórax e abdome ou se disponível um PET/CT (somado a RNM de crânio nos carcinomas anaplásicos).
Para os carcinomas papilíferos, foliculares e oncocíticos o esvaziamento cervical eletivo do compartimento central não é recomendado para tumores T1/T2, não invasivos. Este procedimento deve ser considerado apenas em pacientes com carcinoma papilífero com tumores avançados, T3 ou T4, ou na presença de metástases nos níveis laterais do pescoço (II a V), ou se esta informação for importante no planejamento de terapias adjuvantes [29]. O esvaziamento cervical radical modificado (níveis II a V) e o esvaziamento do compartimento central (nível VI), de indicação terapêutica, devem ser realizados apenas nos pacientes com presença de metástase cervical detectada nas referidas cadeias [19,21,25,29]. Mesmo com os melhores métodos de estadiamento pré-operatórios, e com ultrassom realizado profissionais experientes, metástases para o compartimento central podem deixar de ser diagnosticadas em até 50% dos casos, isto demonstra a importância da inspeção deste nível cervical durante o procedimento cirúrgico.
No carcinoma medular o esvaziamento eletivo do compartimento central é recomendado em todos os pacientes N0. O esvaziamento eletivo dos níveis II a V não apresenta consenso na literatura, e pode ser avaliado em casos que os pacientes apresentem níveis elevados de calcitonina. Quando o paciente apresenta metástase em nível VI, e envolvimento das cadeias laterais de níveis II a V, estas cadeias devem ser submetidas a esvaziamento terapêutico [8,29].
No carcinoma anaplásico considera-se mais apropriado a indicação de esvaziamento do compartimento central e das cadeias laterais de forma terapêutica, nos casos que o tumor primário possa ser ressecado.
Radioiodoterapia
A indicação para terapia complementar com iodo-131 continua apresentando papel importante para tratamento dos tumores papilares, foliculares e oncocíticos da tireoide. O objetivo é a ablação de tecido tireoidiano remanescente e de possíveis metástases, com consequente diminuição de recorrência loco-regional. Na atualidade a indicação para este tratamento está associada a estratificação de risco para recorrência da doença. Os pacientes têm seus perfis clínicos e histológicos pós-operatórios classificados como de baixo, intermediário ou alto risco. Entre os critérios avaliados estão a idade, gênero, o tamanho do tumor, a presença de extravasamento capsular, o subtipo histológico e a presença de metástases. A avaliação do status da dosagem sanguínea de tireoglobulina também se demonstra importante fator para determinar a indicação da radioiodoterapia. Para os tumores de baixo risco não há indicação para tratamento complementar com iodo-131. Para os tumores de risco intermediário a indicação da radioiodoterapia pode ser considerada de acordo com o caso clínico em questão. Já para todos os pacientes considerados como de alto risco, há a indicação formal para complementação do tratamento com radioiodoterapia [20, 21].
Para os tumores de baixo risco não há indicação para tratamento complementar com iodo-131. Para os tumores de risco intermediário a indicação da radioiodoterapia pode ser considerada de acordo com o caso clínico em questão. Já para todos os pacientes considerados como de alto risco, há a indicação formal para complementação do tratamento com radioiodoterapia [20, 21].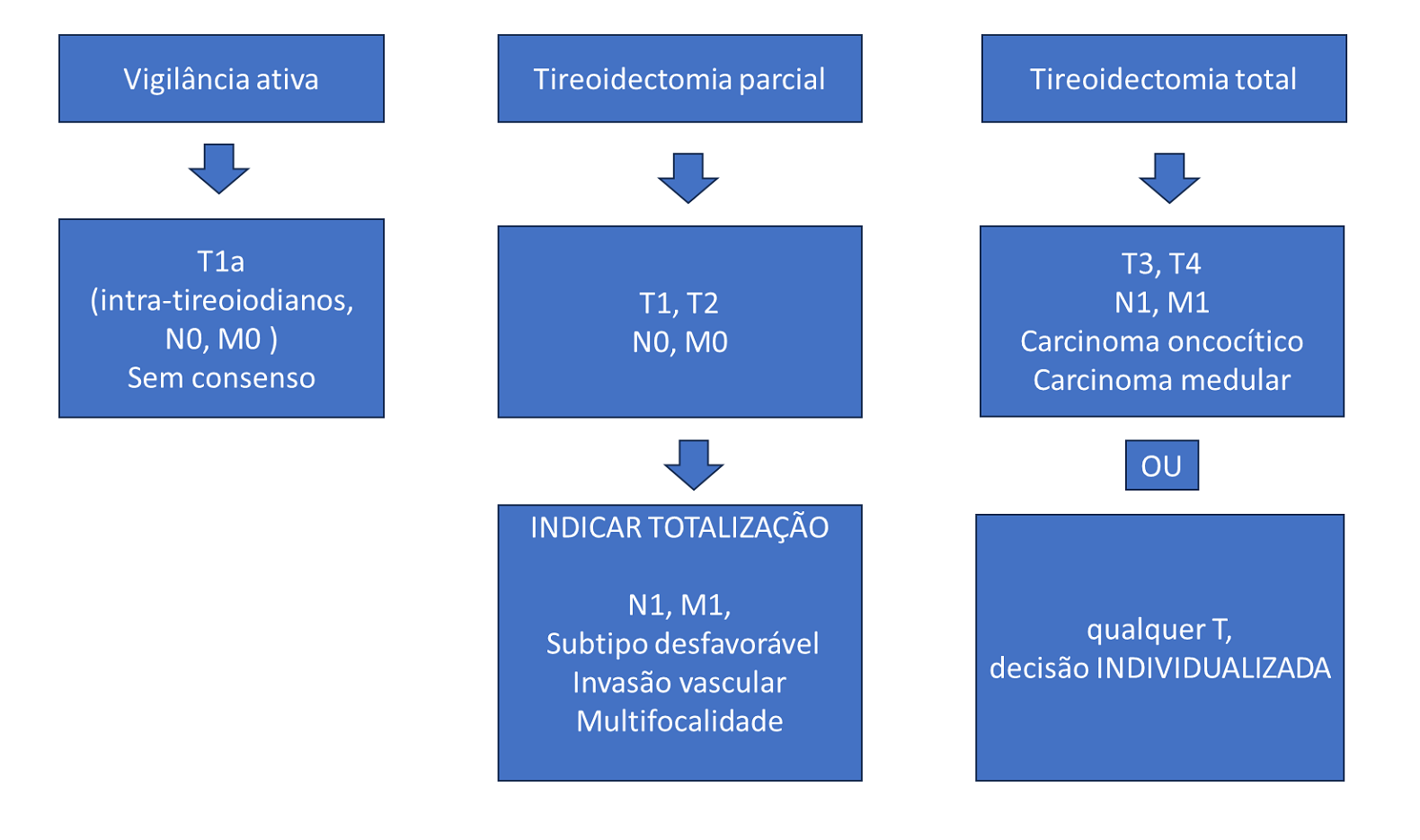
Bibliografia
- Jung CK, Bychkov A, Kakudo K. Update from the 2022 World Health Organization classification of Thyroid Tumors: A Standardized Diagnostic Approach. Endocrinol Metab (Seoul). 2022 Oct;37(5):703-718. doi: 10.3803/EnM.2022.1553. Epub 2022 Oct 4. PMID: 36193717; PMCID: PMC9633223.
- Leenhardt L, Bernier MO, Boin-Pineau MH, Conte Devolx B, Maréchaud R, Niccoli-Sire P, et al. Advances in diagnostic practices affect thyroid cancer incidence in France. Eur J Endocrinol. 2004;150(2):133-9.
- Davies L, Morris LG, Haymart M, Chen AY, Goldenberg D, Morris J, et al.; AACE Endocrine Surgery Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology Disease State Clinical Review: the increasing incidence of thyroid cancer. Endocr Pract. 2015;21(6):686-96.
- Hyeyeun Lim, Susan S. Devesa, Julie A. Sosa, et al. Trends in Thyroid Cancer Incidence and Mortality in the United States, 1974-2013. JAMA. 2017;317(13):1338-1348.
- Aschebrook-Kilfoy B, Ward MH, Sabra MM, Devesa SS. Thyroid cancer incidence patterns in the United States by histologic type, 1992-2006. Thyroid. 2011;21(2):125-34.
- Hundahl SA, Fleming ID, Fremgen AM, Menck HR. A National Cancer Data Base report on 53,856 cases of thyroid carcinoma treated in the U.S., 1985-1995. Cancer. 1998;83(12):2638-48.
- Smallridge RC, Copland JA 2010 Anaplastic thyroid carcinoma: pathogenesis and emerging therapies. Clin Oncol 22:486–497.
- Wells SA Jr, Asa SL, Dralle H, Elisei R, Evans DB, Gagel RF, Lee N, Machens A, Moley JF, Pacini F, Raue F, Frank-Raue K, Robinson B, Rosenthal MS, Santoro M, Schlumberger M, Shah M, Waguespack SG; American Thyroid Association Guidelines Task Force on Medullary Thyroid Carcinoma. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid. 2015 Jun;25(6):567-610.
- Ministério da Saúde, Brasil. Instituto Nacional de Câncer (INCA). Estimativa / 2023 Incidência de Câncer no Brasil, 2023: Esta obra pode ser acessada, na íntegra, na Biblioteca Virtual em Saúde Prevenção e Controle de Câncer (http://controlecancer.bvs.br/) e no Portal do INCA (http://www.inca.gov.br)..
10 – Büllow S. Clinical features in familial polyposis coli. Dis Colon Rectum 1986;29:102-7.
11 – Iwama T, Mishima Y, Utsunomiya J. The impact of familial adenomatous polyposis on the tumorigenesis and mortality at the several organs. Its rational treatment. Ann Surg 1993;217:101-8.
12- Daly MB, Pal T, Berry MP, Buys SS, Dickson P, Domchek SM, Elkhanany A, Friedman S, Goggins M, Hutton ML; CGC; Karlan BY, Khan S, Klein C, Kohlmann W; CGC; Kurian AW, Laronga C, Litton JK, Mak JS; LCGC; Menendez CS, Merajver SD, Norquist BS, Offit K, Pederson HJ, Reiser G; CGC; Senter-Jamieson L; CGC; Shannon KM, Shatsky R, Visvanathan K, Weitzel JN, Wick MJ, Wisinski KB, Yurgelun MB, Darlow SD, Dwyer MA. Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2021 Jan 6;19(1):77-102.
13- Hemminki K, Eng C, Chen B. Familial risks for nonmedullary thyroid cancer. J Clin Endocrinol Metab. 2005 Oct;90(10):5747-53. doi: 10.1210/jc.2005-0935. Epub 2005 Jul 19. PMID: 16030170.
- Yang L, Shen W, Sakamoto N. Population-based study evaluating and predicting the probability of death resulting from thyroid cancer and other causes among patients with thyroid cancer. J Clin Oncol. 2013;31(4):468-74.
- Brierley JD, Gospodarowicz MK, Wittekind C. TNM Classification of Malignant Tumours. 8th ed. Weinheim, Germany: John Wiley & Sons; 2017. p. 69-71.
- Lang BH, Lo CY, Chan WF, Lam KY, Wan KY. Staging systems for papillary thyroid carcinoma: a review and comparison. Ann Surg. 2007;245(3):366-78.
- Voutilainen PE, Siironen P, Franssila KO, Sivula A, Haapiainen RK, Haglund CH. AMES, MACIS and TNM prognostic classifications in papillary thyroid carcinoma. Anticancer Res. 2003;23(5b):4283-8.
- Yildirim E. A model for predicting outcomes in patients with differentiated thyroid cancer and model performance in comparison with other classification systems. J Am Coll Surg. 2005;200(3):378-92. 74
- Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016;26(1):1-133.
- Bible KC, Kebebew E, Brierley J, Brito JP, Cabanillas ME, Clark TJ Jr, Di Cristofano A, Foote R, Giordano T, Kasperbauer J, Newbold K, Nikiforov YE, Randolph G, Rosenthal MS, Sawka AM, Shah M, Shaha A, Smallridge R, Wong-Clark CK. 2021 American Thyroid Association Guidelines for Management of Patients with Anaplastic Thyroid Cancer. Thyroid. 2021 Mar;31(3):337-386.
21 – Haddad RI, Bischoff L, Ball D, Bernet V, Blomain E, Busaidy NL, Campbell M, Dickson P, Duh QY, Ehya H, Goldner WS, Guo T, Haymart M, Holt S, Hunt JP, Iagaru A, Kandeel F, Lamonica DM, Mandel S, Markovina S, McIver B, Raeburn CD, Rezaee R, Ridge JA, Roth MY, Scheri RP, Shah JP, Sipos JA, Sippel R, Sturgeon C, Wang TN, Wirth LJ, Wong RJ, Yeh M, Cassara CJ, Darlow S. Thyroid Carcinoma, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2022 Aug;20(8):925-951.
- Urbach DR, Rotstein LE. Extent of thyroidectomy is not a major determinant of survival in low- or high-risk papillary thyroid cancer. Ann Surg Oncol 2005;12:81–89.
23- Davies L, Welch HG. Thyroid cancer survival in the United States: observational data from 1973 to 2005. Arch Otolaryngol Head Neck Surg 2010;136:440–444.
24 – Adam MA, Pura J, Gu L, et al. Extent of surgery for papillary thyroid cancer is not associated with survival: an analysis of 61,775 patients. Ann Surg 2014;260:601–605; discussion 605–607
25- Mitchell AL, Gandhi A, Scott-Coombes D, Perros P. Management of thyroid cancer: United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol. 2016 May;130(S2):S150-S160.
26 -Takami H, Ito Y, Okamoto T, Onoda N, Noguchi H, Yoshida A. Revisiting the guidelines issued by the Japanese Society of Thyroid Surgeons and Japan Association of Endocrine Surgeons: a gradual move towards consensus between Japanese and western practice in the management of thyroid carcinoma. World J Surg. 2014 Aug;38(8):2002-10.
27- Rosário PW, Ward LS, Graf H, Vaisman F, Mourão GF, Vaisman M . Thyroid nodules lessor equal ti 1 cm and papillary microcarcinomas:Brasilian experts opinion.Arch Endocrinol Metab 2019; 63/5.
28 – Zhao X, Wang JR, Dadu R, et al. Surgery After BRAF-Directed Therapy Is Associated with Improved Survival in BRAFV600E Mutant Anaplastic Thyroid Cancer: A Single-Center Retrospective Cohort Study. Thyroid : Official Journal of the American Thyroid Association. 2023 Apr;33(4):484-491.
29 – Farias T, Kowalski LP, Dias F, Barreira CSR, Vartanian JG, Tavares MR, Vaisman F, Momesso D, Oliveira AF, Pinheiro RN, de Castro Ribeiro HS. Guidelines from the Brazilian society of surgical oncology regarding indications and technical aspects of neck dissection in papillary, follicular, and medullary thyroid cancers. Arch Endocrinol Metab. 2023 May 12;67(4):e000607